超材料与超表面基生物传感器,跨频域技术进展与未来发展方向
在疾病诊断、食品安全监测、环境污染物检测等关键领域,生物传感器的性能直接影响检测效率与精度。传统生物传感器普遍存在灵敏度不足、依赖标记物、检测范围狭窄等局限,难以满足复杂生物样本的精准分析需求。超材料与超表面的出现,为生物传感技术突破提供了新路径——这类人工设计的功能材料凭借独特的光电特性,在电磁频谱多个关键频段实现了对生物分子、微生物的高特异性、高灵敏度检测,已成为当前光子学与生物医学交叉领域的核心研究方向。

一、超材料与超表面:生物传感的核心性能增强平台
要厘清此类传感器的技术优势,需首先明确超材料与超表面的核心特性。**超材料**是一类具有人工设计周期性结构的复合材料,其关键特征在于可同时呈现负介电常数与负磁导率,这一特性使其能够精准调控电磁波的传播、反射与吸收过程;而**超表面**作为超材料的二维等效形式,虽厚度仅处于纳米至微米量级,却可通过精准的结构拓扑设计(如开口环结构、纳米间隙结构、扇形硅块结构等),实现对光场的强约束与可调谐共振。
此类材料的“人工定制化电磁响应能力”,使其成为生物传感的理想技术平台:其可将生物分子的微小变化(如浓度变化、结构变化、相互作用变化)转化为可精确测量的电磁信号(如共振频率偏移、光谱强度变化),且无需依赖传统荧光标记或放射性标记技术,大幅降低了检测干扰与操作复杂度。当前,基于超材料与超表面的生物传感器研究已覆盖电磁频谱的三个关键区域——千兆赫兹(GHz)频段、太赫兹(THz)频段与光学频段,各频段依托独特的作用机制,形成了适配不同生物传感场景的技术方案。
二、跨频域技术进展:从宏观样本筛查到分子级精准识别
1.千兆赫兹(GHz)频段:生物样本快速筛查的核心技术
GHz频段(涵盖射频、微波与毫米波)的超材料传感器,其技术优势集中体现为对生物样本宏观电学特性的高敏感性。由于生物组织或体液的介电常数、电导率会随其成分(如蛋白质浓度、核酸含量、细胞密度)发生规律性变化,GHz频段电磁波在穿透样本时,会因阻抗特性改变产生可量化的信号差异,进而实现样本成分的快速分析。
在技术实现层面,**开口环谐振器(SRR)阵列与微带传输线的集成结构**(如图2所示)是当前主流方案:SRR作为核心传感单元,其内部电磁场会随周围生物样本介电特性的变化而改变共振频率;微带传输线则承担电磁信号传递功能,将共振频率偏移转化为可读取的电学数据。此类传感器尤其适用于血液、尿液等体液样本的快速筛查,例如通过检测全血介电特性变化实现炎症或感染的快速判断——整个检测过程无需复杂样本预处理,典型响应时间可缩短至秒级水平。
2.太赫兹(THz)频段:生物分子无标记识别的分子特征工具
THz频段处于GHz频段与光学频率之间,其独特技术价值在于可匹配生物分子的振动能级——不同生物分子(如DNA、蛋白质、病毒颗粒)在THz波段会呈现特征性“振动指纹”,基于这一特性可实现无标记条件下的分子精准识别。该优势使THz超材料传感器在无标记分析、生物分子鉴定与生物材料成像领域具备不可替代的技术地位。
当前研究中,科研人员通过设计**双开口环谐振器(DSRR)**或**纳米间隙超表面结构**,进一步增强THz波与生物分子的相互作用。以病毒检测为例(如图3d所示),THz纳米间隙超表面可将电磁场集中于纳米级间隙区域,当病毒颗粒进入该区域时,其分子振动会显著改变超材料的共振响应,检测限可低至每毫升数十个病毒颗粒,检测灵敏度远超传统PCR技术的早期诊断能力。此外,THz成像技术可实现生物组织的无损伤断层扫描,例如通过区分正常细胞与癌细胞的结构差异,为病理诊断提供新的技术支撑。
3.光学频段:分子级高灵敏检测的核心技术方案
覆盖可见光与近红外区域的光学频段,是超材料/超表面生物传感器实现最高灵敏度的核心领域。其技术核心在于对光与物质相互作用的精准调控,通过激发表面等离激元共振(LSPR)、Fano共振等物理效应,将检测灵敏度推向分子级甚至单分子水平。
(1)材料与机制的协同创新
贵金属(如金、银)是光学频段的传统核心材料,其表面的LSPR效应可在纳米尺度实现强光场聚集,当生物分子(如抗体、抗原)在材料表面吸附时,会引发LSPR峰的频率偏移,进而实现分子浓度的定量检测;二维材料(如石墨烯、黑磷)的引入进一步拓展了传感器性能——石墨烯的表面等离激元极化激元(SPP)模式可通过栅压调控,实现检测波长的动态调整,适配不同生物分子的吸收特性;黑磷的各向异性则使传感器对特定方向的分子吸附具备更高敏感性。
(2)结构设计的技术突破
为提升检测特异性,科研人员开发了**金属-绝缘体-金属(MIM)超表面**(如图5a)与**全介电超表面**(如图6):MIM结构通过中间绝缘层厚度的精准调控,增强光场约束效应,适用于红外区域的蛋白质结构分析;全介电超表面(如硅基扇形块与十字杆集成结构)则规避了金属材料的光损耗问题,在近红外区域实现生物组织的深层检测,例如通过Fano共振信号的变化实现肿瘤标志物的精准识别。
(3)手性传感的新方向
光学频段的另一重要技术突破是**手性超材料**的应用(如图8)。手性分子(如蛋白质、DNA)会导致偏振光的圆二色性(CD)光谱发生特征性变化,而手性超材料可放大此类微弱信号——例如,通过检测β-乳球蛋白吸附前后CD光谱的偏移量,可快速判断蛋白质是否发生变性,该技术已应用于食品加工中的蛋白质稳定性监测与生物制药领域的质量控制。
三、共性技术瓶颈:从实验室研究到产业化应用的关键挑战
尽管超材料与超表面基生物传感器已取得显著技术进展,但从实验室研究走向规模化产业化应用,仍面临三大核心技术瓶颈:
1.制备工艺的精度与成本协同难题
高性能传感器依赖纳米级精度的结构制备(如数十纳米的SRR间隙、单原子层厚度的二维材料),当前主流制备技术(如电子束光刻、聚焦离子束刻蚀)虽可实现高精度加工,但存在成本高昂、产量低下的问题——例如,一片包含1000个SRR单元的超表面芯片,制备成本通常超过万元,难以满足临床检测等大规模应用场景的成本需求。
2.灵敏度与实用性的协同平衡难题
实验室环境中,传感器可在理想条件(如纯净缓冲液、恒温恒湿环境)下实现超高灵敏度,但实际检测样本(如血液、唾液)中含有大量杂质分子,易引发非特异性吸附,干扰检测信号。如何在保持高灵敏度的同时提升传感器的抗干扰能力,是当前研究的核心方向;此外,灵敏度提升往往伴随成本增加,如何找到“灵敏度-成本”的最优平衡点,是实现技术商业化的关键前提。
3.仿真与实验的数据偏差问题
传感器性能设计通常依赖有限元法(FEM)等仿真工具,但生物样本的复杂性(如动态介电特性、非均匀分布)难以在仿真模型中完全模拟——例如,仿真中假设的“均匀蛋白质溶液”,在实际检测中可能因蛋白质聚集呈现非均匀特性,导致仿真结果与实验数据存在显著偏差。如何构建更精准的生物样本模型,缩小仿真与实验的数据差距,是提升设计效率的关键环节。
四、未来发展方向:多学科融合驱动的智能传感技术革新
针对上述技术瓶颈,超材料与超表面基生物传感器的未来发展将聚焦三大方向:
1.人工智能驱动的智能设计与优化
机器学习技术将成为传感器结构设计的核心工具——通过训练大规模实验数据,算法可自动筛选最优材料组合与结构参数(如SRR的尺寸、间隙宽度),甚至预测传感器在复杂生物样本中的响应特性,大幅降低实验试错成本。例如,基于深度学习的模型已实现对石墨烯超表面在不同pH环境下LSPR峰偏移的精准预测,设计效率提升10倍以上。
2.微型化与即时检测(Point-of-CareTesting,POCT)技术发展
随着微纳加工技术的进步,传感器将向“芯片级”与“可穿戴式”方向推进。例如,将THz纳米间隙超表面集成于柔性芯片,可制备贴肤式传感器,实现汗液中葡萄糖、乳酸浓度的实时监测,为糖尿病患者或运动员提供即时健康数据;集成微流控通道的光学超表面芯片,可实现“一滴血”快速检测新冠病毒、肿瘤标志物等目标分子,检测时间可缩短至5分钟以内。
3.生物界面与转换器的协同设计
当前传感器研究多聚焦于“转换器”(即超材料/超表面的电磁响应特性),对“生物界面”(即传感器表面与生物分子的相互作用)的关注相对不足。未来研究将强化两者的协同设计——例如,在超表面表面修饰特异性适配体或抗体,提升对目标分子的选择性;通过调控表面亲疏水性,减少非特异性吸附。“生物界面-转换器”的协同优化,将成为提升传感器综合性能的核心突破口。
超材料与超表面基生物传感器依托跨频域的电磁调控能力,已在生物分子识别、微生物检测、生物组织成像等领域展现出巨大应用潜力,成为衔接光子学、材料科学与生物医学领域的关键技术桥梁。尽管当前面临制备工艺、成本控制、仿真验证等技术挑战,但随着人工智能、微纳加工、生物工程等多学科技术的深度融合,此类传感器有望向“更高灵敏度、更低成本、更微型化”的方向推进,最终在精准医疗、食品安全、环境监测等领域实现规模化应用,为人类健康保障与公共安全防护提供更强大的技术支撑。
-

半导体抛光设备自动化应用及工艺质量管控要点探析
在半导体器件规模化量产进程中,抛光工艺作为保障晶圆加工精度与表面质量的核心环节,其设备自动化水平、工艺参数调控能力、检测体系完善度及异常处置效率,直接决定生产效率、工艺稳定性与产品良率。本文从抛光设备自动化配置要求、核心工艺参数调控、关键检测指标界定及常见工艺异常处理四个维度,系统阐述半导体抛光工艺的质量管控核心要点,为半导体抛光制程的标准化、精细化实施提供参考。
2026-02-12
-
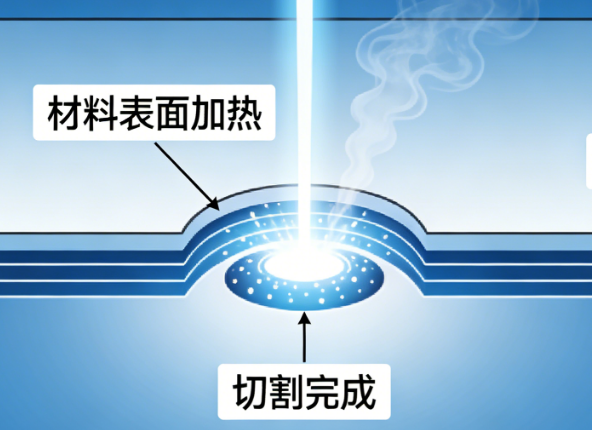
硅晶圆激光切割核心技术深度解析:原理、工艺与质量把控
在半导体制造产业链中,硅晶圆切割是芯片成型的关键工序,其加工精度与效率直接影响芯片良品率和产业发展节奏。随着微电子器件向微型化、薄型化升级,传统切割方式的弊端逐渐显现,激光切割凭借高精度、低损伤的技术优势成为行业主流。本文从激光切割系统的硬件构成出发,深入拆解隐形切割与消融切割两大核心工艺,解析光斑、焦点的精度控制逻辑,并探讨切割质量的评价维度与效率平衡策略,系统梳理硅晶圆激光切割的核心技术体系
2026-02-12
-
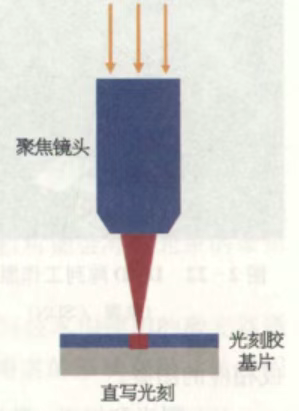
无掩模激光直写技术研究概述
无掩模激光直写技术作为微纳加工领域的先进光刻技术,摒弃了传统光刻工艺对掩模版的依赖,凭借直接写入的核心特性,在复杂微纳结构制备、高精度图案加工中展现出独特优势,成为微纳加工领域的重要技术方向。本文从工作原理与流程、技术特性、现存挑战、分辨率与对准参数、核心设备及厂务动力配套要求等方面,对该技术进行全面梳理与阐述。
2026-02-12
-

SiC功率器件的高温时代:封装成为行业发展核心瓶颈
在半导体功率器件技术迭代进程中,碳化硅(SiC)凭借高温工作、高电流密度、高频开关的核心优势,成为推动功率半导体升级的关键方向,其普及大幅提升了器件的功率密度与工作效率,为功率半导体行业发展带来全新机遇。但与此同时,行业发展的核心瓶颈正悄然从芯片设计与制造环节,转移至封装层面。当SiC将功率器件的工作温度与功率密度不断推高,芯片本身已具备承受更高应力的能力,而封装环节的材料适配、热路径设计等问题却日益凸显,高温与快速功率循环叠加的工况下,焊料与热路径成为决定SiC功率模块寿命的核心因素,封装技术的发展水平,正成为制约SiC功率器件产业化落地与长期可靠应用的关键。
2026-02-12







