晶体、非晶质体与胶体的结构特征及性质差异研究
在材料科学领域,物质的微观结构是决定其宏观性质与应用场景的核心因素。晶体、非晶质体与胶体作为三类典型的固体形态,其内部质点(原子、离子、分子或离子团)的排列方式存在本质差异,进而表现出截然不同的物理化学特性。本文基于空间格子理论与质点排列规律,系统阐述三类物质的结构本质、核心特征及相互转化关系,为理解材料微观结构与宏观性能的关联提供理论支撑。
一、晶体:具有长程有序格子构造的固体体系
晶体的核心定义在于其内部质点在三维空间的周期性重复排列,这种有序性贯穿整个晶体结构,形成“长程有序”的格子构造,这一特征已通过X射线衍射技术得到证实。
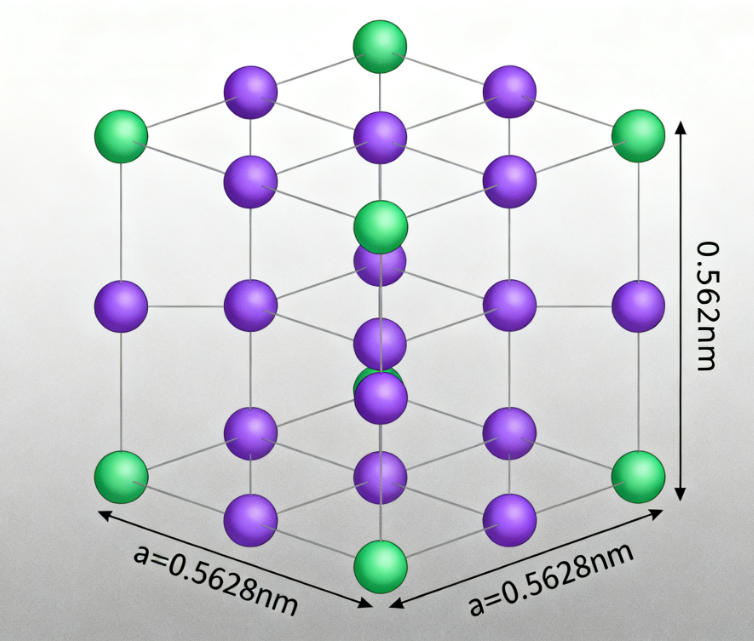
以石盐(NaCl)晶体为例,其微观结构中,氯离子(Cl⁻)与钠离子(Na⁺)呈立方对称分布:沿立方体棱边方向,两类离子的重复间距为0.5628nm;沿立方体对角线方向,重复间距为0.3973nm。无论石盐的宏观形态是否规则(如天然立方体结晶或人工研磨后的细粒),其内部质点始终遵循这一立方格子排列规律。
为精准描述晶体的重复结构,引入“晶胞”概念——晶胞是晶体结构中能代表其重复规律的最小结构单元,相当于晶体的“基本建筑模块”。将单个晶胞在三维空间中无限重复堆砌,即可构成完整的晶体结构。石盐的晶胞为立方体型,氯离子位于晶胞顶点与面心,钠离子位于晶胞体心与棱心,这种结构单元的重复排列,是石盐宏观性质的微观基础。
二、点阵与空间格子:晶体有序结构的抽象表征
为简化晶体长程有序结构的描述,科学家通过抽象化方法构建了“点阵”与“空间格子”模型,二者共同构成解析晶体重复规律的“数学工具”。
(一)点阵:晶体重复规律的抽象化表达
点阵的构建基于“相当点”的提取:在晶体结构中,选取一系列物质组成与几何环境完全等效的点(如石盐中所有氯离子的中心,或所有钠离子的中心),这些点被称为“相当点”。将所有相当点抽象为无物质属性的几何点,即形成“点阵”。
点阵的核心特征是“平移对称性”——若将点阵沿任意方向平移特定距离(即相邻点阵点的间距),平移后的点阵与原点点阵完全重合。这一特性表明,点阵本质上是晶体重复规律的简化反映:不同成分的晶体,若内部质点排列规律一致,其点阵结构完全相同。
(二)空间格子:点阵的三维具象化模型
当点阵从二维平面扩展至三维空间时,即形成“空间格子”,其核心构成要素及特征如下:
1.结点:空间格子中的几何点,对应晶体中的相当点,是空间格子的基本构成单元;
2.行列:由任意两个结点连接形成的直线,即三维空间中的“直线点阵”。同一方向的平行行列,其相邻结点间距(简称“结点间距”)恒定;不同方向的行列,结点间距通常存在差异;
3.网面:由不在同一直线上的三个结点确定的平面,即三维空间中的“平面点阵”。相邻网面的垂直距离称为“网面间距”,单位面积内的结点数量称为“网面密度”。二者呈正相关:网面密度越大,网面间距越大;
4.平行六面体:空间格子的最小结构单元,由三个不共面的行列围成。其形状与大小由三个棱长(a、b、c)及棱长间的夹角(α、β、γ)共同决定,这六个参数被称为“空间格子参数”。平行六面体与晶体的晶胞呈几何对应关系,晶胞的形状与大小完全由空间格子参数决定。
从理论层面可将晶体结构、点阵与基元的关系概括为:晶体结构=点阵+基元。其中,“基元”是点阵点对应的具体物质实体(可为原子、分子、离子或离子团),通过在点阵的每个结点上按统一方式安置基元,即可构建完整的晶体结构。
三、晶体的基本性质:长程有序结构的宏观体现
晶体的长程有序格子构造,决定了其与非晶质体截然不同的六大基本性质,这些性质是晶体结构的直接宏观反映:
(一)均一性
由于晶体内部质点呈周期性均匀排列,在宏观可测范围内,晶体不同部位的物理性质(如密度、硬度、折射率)与化学性质(如溶解度、化学活性)完全一致。例如,水晶(SiO₂晶体)的任意切片,其折射率与透光性均无差异。
(二)自限性
在热力学条件适宜(如缓慢冷却、生长空间充足)的情况下,晶体会自发形成由晶面(平面)、晶棱(直线)与顶点构成的几何多面体外形。这一过程是质点按格子构造规律生长的必然结果,如雪花自发形成六角形对称结构,方解石常呈现菱面体形态。
(三)异向性
晶体内部质点在不同方向上的排列密度与作用力存在差异,导致其性质随方向变化。例如,蓝晶石(Al₂SiO₅)的硬度具有明显异向性:沿某一方向可被指甲刻划,沿垂直方向则需小刀才能留下痕迹;方解石的“双折射”现象也源于此——光线沿不同方向进入晶体时,会分解为两条传播方向不同的折射光。
(四)对称性
尽管晶体具有异向性,但在特定方向上,其结构与性质会呈现规律性重复,即“对称性”。晶体的对称特征体现在宏观外形(如晶面、晶棱的重复)与内部结构(如网面、行列的重复)两方面。例如,金刚石(立方晶系)具有9个对称面、12条对称轴,其宏观形态的规整性即源于这一对称特征。
(五)最小内能性
在相同的温度、压力条件下,晶体的内能(质点热运动与相互作用能的总和)低于同种物质的液态与气态。这是因为质点在格子构造中处于能量平衡状态,无需额外能量维持无序排列,是晶体稳定性的能量基础。
(六)稳定性
基于最小内能性,晶体在相同热力学条件下,比同种成分的非晶质体更稳定。非晶质体可自发向晶体转变(如玻璃的脱玻化),但晶体不会自发转化为非晶质体,仅在极端条件(如高温熔融、放射性辐射)下,其格子构造被破坏后才可能转变为非晶态。
四、非晶质体:长程无序的过冷液态固体
非晶质体是与晶体相对的固体形态,其核心特征为内部质点的长程无序性——仅在近邻范围内(如1~2个质点间距)存在局部有序(即“短程有序”),但这种有序性无法扩展至整个体系,不具备晶体的格子构造。
日常生活中最典型的非晶质体为玻璃(主要成分为SiO₂):玻璃由熔融石英砂快速冷却形成,冷却速度过快导致硅原子与氧原子来不及按规律排列,最终被“冻结”在无序状态。基于这一结构特征,非晶质体表现出以下关键性质:
1.无固定熔点:加热时,非晶质体先逐渐软化,随后流动性增强,最终变为熔融态,不存在晶体的“突变式熔化”过程;
2.无自限性:无法自发形成规则几何多面体,宏观形态由外部容器或加工方式决定(如玻璃的板材、管材形态);
3.各向同性:由于质点排列无方向性,其物理性质(如折射率、热导率)在不同方向上保持一致;
4.热力学不稳定性:非晶质体的内能高于晶体,在长期放置或温和加热条件下,会自发向晶体转变,这一过程称为“脱玻化”。例如,古代玻璃制品表面出现的“结晶纹”,即是非晶质体向晶体转化的结果。
自然界中的非晶质体还包括火山玻璃(岩浆快速冷却形成)、琥珀(树脂化石的非晶态)等,其分布范围远小于晶体,仅占固体物质的极小比例。
五、胶体:晶体与非晶质体之间的过渡体系
胶体是由“分散相”与“分散媒”组成的多相细分散体系,其中分散相颗粒的直径介于1~100nm之间,是介于晶体与非晶质体之间的过渡形态。
(一)胶体的分类与结构特征
根据分散相与分散媒的状态,胶体可分为多种类型,但在矿物与材料领域,最常见的为“水凝胶体”与“结晶胶体”:
水凝胶体:分散媒为水,分散相为固态颗粒(如蛋白石,分散相为SiO₂微粒);
结晶胶体:分散媒为晶态物质,分散相可为气体、液体或固体(如乳石英,分散相为气泡)。
胶体的结构特殊性体现在分散相颗粒的排列状态:分散相颗粒本身可能为晶态(如Fe(OH)₃胶体颗粒),具有短程有序结构,但由于颗粒尺寸极小且排列杂乱,从宏观层面看,胶体不具备规则外形,物理性质表现为各向同性,常被归为“非晶质体”范畴。
(二)胶体的关键性质与转变
胶体的核心特征为“热力学不稳定性”:分散相颗粒的比表面积(总表面积与体积之比)极大,表面自由能较高,因此颗粒会自发合并为更大的聚集体,同时排出分散媒,这一过程称为“陈化”(老化)。
以蛋白石为例,在干燥环境中,其内部的SiO₂分散相颗粒会逐渐合并,水分缓慢脱失,颗粒尺寸从纳米级增长至微米级,最终形成显晶质的石英。这一过程中,胶体从非晶态过渡至晶态,形成的晶体被称为“变胶体矿物”,是胶体向晶体转化的典型案例。
六、结论:结构决定性质的核心逻辑
晶体、非晶质体与胶体的本质差异,源于其内部质点排列方式的不同:
晶体以长程有序的格子构造为核心,决定了其固定熔点、自限性、异向性等特征;
非晶质体以长程无序、短程有序为特征,表现为无固定熔点、各向同性与热力学不稳定性;
胶体作为过渡体系,分散相颗粒的微观有序与宏观杂乱并存,通过陈化可向晶体转化。
三类物质的结构性质关联,是材料科学领域设计功能材料的重要依据。例如,基于晶体的有序结构可制备高性能半导体、光学晶体;基于非晶质体的软化特性可生产玻璃、非晶合金;基于胶体的分散特性可研发催化剂、吸附材料。深入理解其微观结构规律,对推动材料创新与产业应用具有重要意义。
-

半导体抛光设备自动化应用及工艺质量管控要点探析
在半导体器件规模化量产进程中,抛光工艺作为保障晶圆加工精度与表面质量的核心环节,其设备自动化水平、工艺参数调控能力、检测体系完善度及异常处置效率,直接决定生产效率、工艺稳定性与产品良率。本文从抛光设备自动化配置要求、核心工艺参数调控、关键检测指标界定及常见工艺异常处理四个维度,系统阐述半导体抛光工艺的质量管控核心要点,为半导体抛光制程的标准化、精细化实施提供参考。
2026-02-12
-
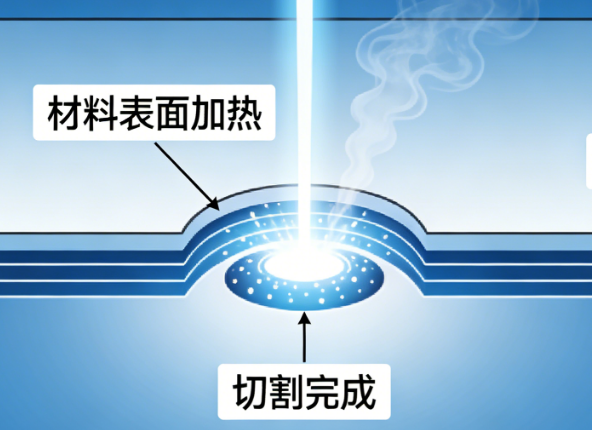
硅晶圆激光切割核心技术深度解析:原理、工艺与质量把控
在半导体制造产业链中,硅晶圆切割是芯片成型的关键工序,其加工精度与效率直接影响芯片良品率和产业发展节奏。随着微电子器件向微型化、薄型化升级,传统切割方式的弊端逐渐显现,激光切割凭借高精度、低损伤的技术优势成为行业主流。本文从激光切割系统的硬件构成出发,深入拆解隐形切割与消融切割两大核心工艺,解析光斑、焦点的精度控制逻辑,并探讨切割质量的评价维度与效率平衡策略,系统梳理硅晶圆激光切割的核心技术体系
2026-02-12
-
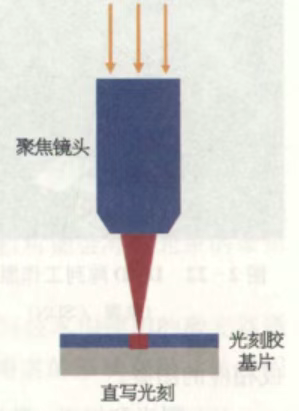
无掩模激光直写技术研究概述
无掩模激光直写技术作为微纳加工领域的先进光刻技术,摒弃了传统光刻工艺对掩模版的依赖,凭借直接写入的核心特性,在复杂微纳结构制备、高精度图案加工中展现出独特优势,成为微纳加工领域的重要技术方向。本文从工作原理与流程、技术特性、现存挑战、分辨率与对准参数、核心设备及厂务动力配套要求等方面,对该技术进行全面梳理与阐述。
2026-02-12
-

SiC功率器件的高温时代:封装成为行业发展核心瓶颈
在半导体功率器件技术迭代进程中,碳化硅(SiC)凭借高温工作、高电流密度、高频开关的核心优势,成为推动功率半导体升级的关键方向,其普及大幅提升了器件的功率密度与工作效率,为功率半导体行业发展带来全新机遇。但与此同时,行业发展的核心瓶颈正悄然从芯片设计与制造环节,转移至封装层面。当SiC将功率器件的工作温度与功率密度不断推高,芯片本身已具备承受更高应力的能力,而封装环节的材料适配、热路径设计等问题却日益凸显,高温与快速功率循环叠加的工况下,焊料与热路径成为决定SiC功率模块寿命的核心因素,封装技术的发展水平,正成为制约SiC功率器件产业化落地与长期可靠应用的关键。
2026-02-12







