显微成像中像素与分辨率的关系解析:高像素并非清晰度的唯一标准
许多初次使用显微镜的研究者常会下意识地将相机像素参数调至最高——其认知逻辑多源于日常摄影场景中“高像素即等同于高清晰度”的普遍认知。然而,实际拍摄后却发现,即便像素参数拉满,所得的细胞或微观结构图像仍存在模糊问题,甚至因文件体积过大导致计算机处理效率下降。这一现象引发关键疑问:在显微成像领域,“清晰度”的判定是否与像素数量呈正相关?
事实上,显微成像的技术逻辑与日常摄影存在本质差异。若要获取高质量的微观图像,首先需明确两个核心概念的界定——像素与分辨率,二者分属不同技术范畴,不可等同视之。

一、核心概念辨析:像素与分辨率并非同一范畴
将“高像素”直接等同于“高清晰度”,本质是混淆了“探测器硬件属性”与“光学系统性能能力”的概念边界。二者的技术定义与功能定位存在明确差异:
像素(Pixel):作为图像传感器(感光元件)的核心硬件指标,其本质是传感器上用于记录光信号的离散单元(即“像素点”)数量。像素数量决定了图像可承载的“数字信息总量”,但该信息的“质量高低”(即细节清晰度)并不由像素数量单独决定。
分辨率(Resolution):作为显微镜光学系统的核心性能指标,其定义为光学系统对相邻两个微观质点的区分能力。例如,对于间距为150nm的两个荧光标记点,分辨率达标的光学系统可清晰识别为两个独立质点,而分辨率不足的系统则会将其呈现为单一模糊光斑。
以通俗案例类比:若将显微镜光学系统比作“人眼”,像素则相当于“笔记本上的书写格子”。若“人眼”本身无法清晰辨识远处的文字(即光学分辨率不足),即便将笔记本的书写格子绘制得再密集(即高像素),记录下的文字内容依然模糊——仅能实现“对模糊信息的精细化记录”,无法通过增加格子数量使文字本身变得清晰。类似地,将低分辨率的叶脉图像强行放大至8K像素规格,虽像素总量大幅提升,但叶脉纹理的细节清晰度并未改善,根源在于原始光学分辨率未得到提升。
二、显微镜清晰度上限的决定因素:光学系统的核心作用
显微成像中“可观测细节的精细程度”(即清晰度上限),主要由显微镜的光学系统性能决定,核心影响因素包括以下三方面:
1.物镜数值孔径(NA):调控分辨率的关键参数
物镜表面标注的数值孔径(NA)值(如1.4、0.75等),代表物镜对光线的收集能力——NA值越大,光学系统的分辨率越高。这一参数的作用机制类似光学观测工具的“视野精度”:高NA值物镜(如NA=1.4)可收集更多来自样本的光信号,从而捕捉更细微的结构差异;而低NA值物镜(如NA=0.75)则因光线收集能力有限,难以分辨精细结构。
行业内常用的横向分辨率计算公式为:横向分辨率≈成像光波长÷(2×NA)。以常见的488nm波长绿光为例,搭配NA=1.4的高倍物镜时,横向分辨率可达约174nm;若更换为NA=0.75的物镜,横向分辨率则降至325nm——即便后续提升像素数量,也无法观测到174nm至325nm区间内的微观细节。
2.成像光波长:分辨率的基础影响因素
成像光的波长与显微镜分辨率呈负相关关系——波长越短,分辨率越高。例如,蓝光(波长400500nm)的分辨率显著高于红光(波长600700nm):在搭配NA=1.4物镜的条件下,蓝光可实现约140nm的横向分辨率,而红光的横向分辨率仅能达到250nm。这也是超分辨显微技术常采用短波长激光作为光源的核心原因——通过缩短成像光波长,突破传统光学系统的“衍射极限”。
3.成像方式:决定分辨率上限的技术维度
不同的显微成像技术,其分辨率上限存在显著差异,具体可分为三类:
宽场显微镜:为实验室最常用的基础成像设备,但受光学衍射极限限制,分辨率通常维持在200nm左右,无法满足病毒、蛋白质复合物等超微结构的观测需求;
激光共聚焦显微镜:通过激光束聚焦与针孔筛选减少杂散光干扰,分辨率较宽场显微镜略有提升,可达150180nm,适用于细胞内三维结构的观测;
超分辨显微镜(如STED、SIM、STORM等技术):通过特殊光学设计直接突破衍射极限,分辨率可降至100nm以下,部分技术甚至能实现50nm级别的观测精度,可用于细胞膜蛋白分布、线粒体精细结构等超微场景的研究。
简而言之,若光学系统的分辨率上限为200nm,即便将像素参数调整至可记录20nm细节的水平,最终成像仍仅能呈现200nm级别的细节,多余的像素设置仅会增加数据冗余,无法提升实际观测精度。
三、像素的技术定位:实现对光学细节的精准数字化采样
像素虽不直接决定分辨率,但其在显微成像中承担着关键功能——将光学系统可分辨的细节精准转化为数字图像。像素参数的设置核心在于“适配性”,而非“数量最大化”,具体表现为以下两种极端情况的弊端:
采样不足(像素数量过少):当像素间距大于光学分辨率时,会导致细节信息丢失,图像呈现明显的“锯齿感”。例如,若光学系统分辨率为200nm,但像素间距设为300nm,观测细胞骨架时,原本连续的微管结构会呈现为分段式“断珠状”,无法完整呈现其形态特征;
采样过量(像素数量过多):当像素间距远小于光学分辨率时,图像细节不会增加,但文件体积会呈指数级增长——例如,将200nm分辨率系统的像素间距设为20nm,图像文件体积会从原本的几MB增至几十MB,不仅占用更多存储资源,还会导致计算机处理速度下降,影响实验效率。
针对像素参数的合理设置,行业公认的“黄金法则”为Nyquist采样率:像素间距应约为光学分辨率的1/2,此设置可在完整捕捉光学系统所能呈现的全部细节的同时,避免数据冗余。以光学分辨率为200nm的系统为例,像素间距设为100nm左右即可满足需求;若系统分辨率为150nm,则像素间距调整为75nm为宜。
以激光共聚焦显微镜观测HeLa细胞微管结构(微管直径约25nm)为例,不同像素设置的成像效果差异显著:
当像素间距设为200nm/像素时:微管结构呈断裂状态,无法呈现连续的形态特征;
当像素间距设为80100nm/像素时:微管走向清晰,分支结构可完整辨识,符合观测需求;
当像素间距设为20nm/像素时:图像文件体积从5MB增至50MB,计算机加载与处理速度明显下降,但微管细节与80100nm/像素设置下完全一致,属于典型的“无效高像素设置”。
四、实践总结:显微成像的参数适配逻辑
若要获取高质量的显微图像,无需盲目追求高像素参数,可遵循以下三步操作逻辑,实现光学系统与像素设置的精准适配:
1.明确光学系统分辨率上限:通过物镜NA值、成像光波长及成像方式,计算并确认显微镜的实际分辨率(例如,NA=1.4的物镜搭配激光共聚焦成像,分辨率约为150nm);
2.依据Nyquist原则设置像素参数:以光学分辨率的1/2为标准确定像素间距(如150nm分辨率对应75nm/像素的间距设置);
3.规避无效高像素设置:避免为追求“高参数”而将像素间距调至远小于光学分辨率的水平,防止数据冗余与计算机处理效率下降。
显微成像的核心技术目标,并非“堆砌硬件参数”,而是精准匹配光学系统性能与数字化采样需求。正如专业摄影师需结合光线、构图优化成像效果,而非仅依赖相机像素;显微操作的关键也在于理解光学系统的“性能边界”,通过像素与分辨率的合理适配,使每一个像素单元均能有效服务于细节呈现,最终实现微观世界的清晰观测。
-

半导体抛光设备自动化应用及工艺质量管控要点探析
在半导体器件规模化量产进程中,抛光工艺作为保障晶圆加工精度与表面质量的核心环节,其设备自动化水平、工艺参数调控能力、检测体系完善度及异常处置效率,直接决定生产效率、工艺稳定性与产品良率。本文从抛光设备自动化配置要求、核心工艺参数调控、关键检测指标界定及常见工艺异常处理四个维度,系统阐述半导体抛光工艺的质量管控核心要点,为半导体抛光制程的标准化、精细化实施提供参考。
2026-02-12
-
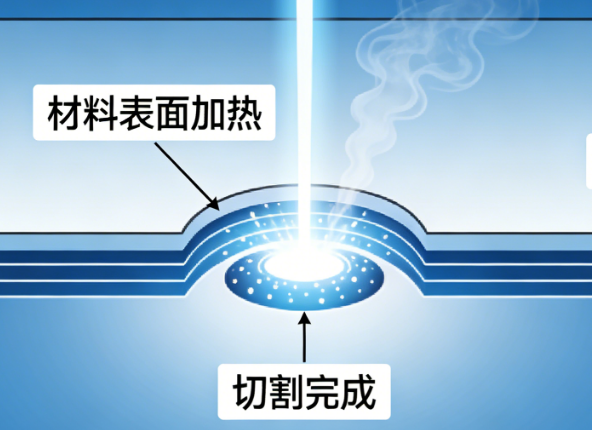
硅晶圆激光切割核心技术深度解析:原理、工艺与质量把控
在半导体制造产业链中,硅晶圆切割是芯片成型的关键工序,其加工精度与效率直接影响芯片良品率和产业发展节奏。随着微电子器件向微型化、薄型化升级,传统切割方式的弊端逐渐显现,激光切割凭借高精度、低损伤的技术优势成为行业主流。本文从激光切割系统的硬件构成出发,深入拆解隐形切割与消融切割两大核心工艺,解析光斑、焦点的精度控制逻辑,并探讨切割质量的评价维度与效率平衡策略,系统梳理硅晶圆激光切割的核心技术体系
2026-02-12
-
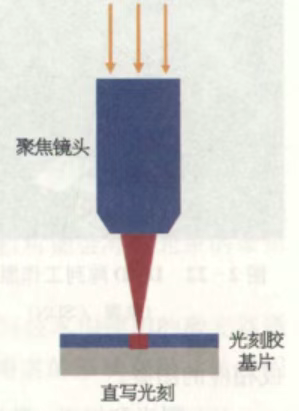
无掩模激光直写技术研究概述
无掩模激光直写技术作为微纳加工领域的先进光刻技术,摒弃了传统光刻工艺对掩模版的依赖,凭借直接写入的核心特性,在复杂微纳结构制备、高精度图案加工中展现出独特优势,成为微纳加工领域的重要技术方向。本文从工作原理与流程、技术特性、现存挑战、分辨率与对准参数、核心设备及厂务动力配套要求等方面,对该技术进行全面梳理与阐述。
2026-02-12
-

SiC功率器件的高温时代:封装成为行业发展核心瓶颈
在半导体功率器件技术迭代进程中,碳化硅(SiC)凭借高温工作、高电流密度、高频开关的核心优势,成为推动功率半导体升级的关键方向,其普及大幅提升了器件的功率密度与工作效率,为功率半导体行业发展带来全新机遇。但与此同时,行业发展的核心瓶颈正悄然从芯片设计与制造环节,转移至封装层面。当SiC将功率器件的工作温度与功率密度不断推高,芯片本身已具备承受更高应力的能力,而封装环节的材料适配、热路径设计等问题却日益凸显,高温与快速功率循环叠加的工况下,焊料与热路径成为决定SiC功率模块寿命的核心因素,封装技术的发展水平,正成为制约SiC功率器件产业化落地与长期可靠应用的关键。
2026-02-12







