突破深层组织成像瓶颈:北大团队研发双重共聚焦超分辨显微技术
在生命科学研究中,看清细胞的精细结构、追踪组织深层的动态变化,始终是科学家们追求的目标。超分辨显微成像技术的出现,曾让人们突破光学衍射极限,得以窥探纳米尺度的生物世界。但当镜头对准深层组织时,散射干扰、信号保真度下降等问题却像一层迷雾,让精细结构的观测变得困难重重。
北京大学席鹏教授团队提出的“双重共聚焦转盘图像扫描显微技术”(C²SD-ISM),为破解这一难题带来了曙光。这项发表于国际光学顶尖期刊《Light:Science&Applications》的成果,实现了180μm深度下的高保真三维超分辨成像,为深层组织研究提供了全新的“透视眼”。
深层组织成像:传统技术的“绊脚石”
要理解C²SD-ISM的突破,首先需要看清现有技术的局限。
受激发射损耗显微镜(STED)依靠“甜甜圈”形损耗光提升分辨率,但这种特殊光束在深层组织中易被散射扭曲,导致成像质量大幅下降;结构光照明显微镜(SIM)依赖条纹光照明,可条纹在复杂组织中易被扰乱,重建图像时容易混入“假信号”;单分子定位显微镜(SMLM)则会因背景荧光和散射,降低定位精度,让结构信息失真。
即便是作为共聚焦技术拓展的图像扫描显微镜(ISM),虽能通过像素重分配提升近2倍分辨率,却仍在深层组织中面临背景干扰、成像深度受限、保真度不足等挑战。如何在分辨率、成像深度与信号真实性之间找到平衡,成为横亘在科学家面前的关键问题。
双重共聚焦:给显微镜加“双保险”
席鹏团队提出的C²SD-ISM,核心创新在于“双重共聚焦”机制,像是给显微镜装上了两道“过滤门”,层层剔除干扰信号。
第一道“门”由转盘共聚焦显微镜构成。它通过物理方式直接去除离焦信号,就像给镜头装上“遮光罩”,只让焦平面内的真实信号通过,从源头减少背景干扰。
第二道“门”则融合了数字微镜器件(DMD)与智能算法。DMD实现稀疏多焦点照明,相当于用精准的“光点阵列”照亮样本;配合团队研发的动态针孔阵列像素重分配算法(DPA-PR),对信号进行超分辨重建。这种算法能构建5×5虚拟探测器阵列,从原始图像中提取多个视角的子图,通过相位互相关计算修正偏移,最终重建出高保真图像。
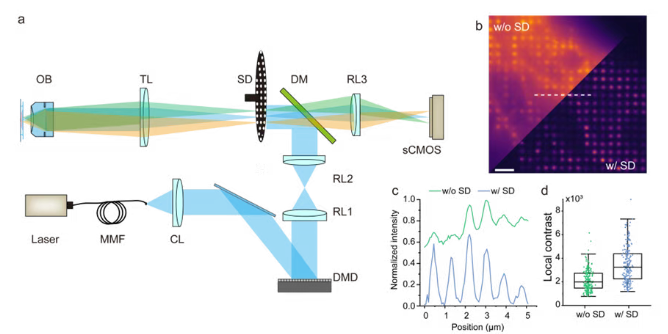
双重保障下,C²SD-ISM展现出显著优势:在厚样本和密集多点激发模式下,仍能保持高清晰度的激发光斑;相比传统多点结构光超分辨技术(MSIM),所需原始图像数量减少约6倍,大幅提升了成像效率。更重要的是,重建图像与原始共聚焦图像的线性相关系数高达92%,意味着信号真实性得到了严格保障。
实验验证:从肾组织到斑马鱼的“清晰透视”
在小鼠肾组织切片的强散射区域实验中,C²SD-ISM的稳定性得到了充分验证。与单纯依靠计算去除背景的方法相比,它不仅能保留弱信号区域的结构连续性,还能维持信号强度分布的线性关系——这意味着科学家看到的,是组织最真实的“原貌”。
对EGFP标记的斑马鱼血管系统进行成像时,C²SD-ISM的优势更为直观。在2.91mm×1.26mm×0.18mm的体积范围内,它清晰呈现了传统共聚焦技术难以分辨的精细血管结构,让血管的分支、形态细节一目了然。
更令人惊喜的是,通过在DMD上加载条纹图案,该系统还能切换至SIM模态。在霉菌样本上,它实现了66.5×66.5×50μm的三维成像,分辨率提升约1.68倍,突破了传统SIM的深度限制;对斑马鱼心外膜组织成像时,更是清晰揭示了亚细胞尺度的精细结构。
未来展望:从实验室到更广阔的应用场景
C²SD-ISM的价值,不仅在于当下的突破,更在于其广阔的拓展空间。
团队已将关键资源开源,包括转盘设计代码、超分辨重建算法、硬件控制代码等(https://github.com/Chauncey-Leung/C2SD-ISM),这将加速技术的推广与合作。部分成果还已转化为商业产品Nova-SD转盘共聚焦,支持7色激发、25mm大视野,原始横向分辨率达230nm,成像速度高达2000fps,为科研机构提供了实用工具。
未来,结合深度学习去噪、自适应光学校正等技术,C²SD-ISM有望进一步突破成像深度与尺度限制;其DMD可编程特性,还为低光毒性观察活细胞动态过程提供了可能。从细胞成像到组织尺度研究,这项技术正逐渐成为推动生物学发展的重要力量。
当显微镜能更清晰、更真实地“看透”深层组织,生命科学的许多未知领域,或许将迎来新的发现浪潮。
-

半导体抛光设备自动化应用及工艺质量管控要点探析
在半导体器件规模化量产进程中,抛光工艺作为保障晶圆加工精度与表面质量的核心环节,其设备自动化水平、工艺参数调控能力、检测体系完善度及异常处置效率,直接决定生产效率、工艺稳定性与产品良率。本文从抛光设备自动化配置要求、核心工艺参数调控、关键检测指标界定及常见工艺异常处理四个维度,系统阐述半导体抛光工艺的质量管控核心要点,为半导体抛光制程的标准化、精细化实施提供参考。
2026-02-12
-
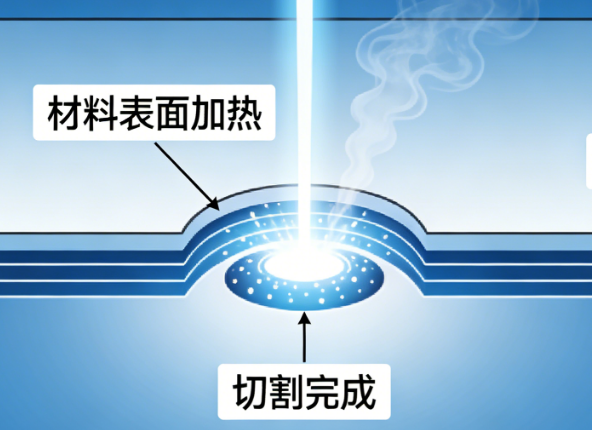
硅晶圆激光切割核心技术深度解析:原理、工艺与质量把控
在半导体制造产业链中,硅晶圆切割是芯片成型的关键工序,其加工精度与效率直接影响芯片良品率和产业发展节奏。随着微电子器件向微型化、薄型化升级,传统切割方式的弊端逐渐显现,激光切割凭借高精度、低损伤的技术优势成为行业主流。本文从激光切割系统的硬件构成出发,深入拆解隐形切割与消融切割两大核心工艺,解析光斑、焦点的精度控制逻辑,并探讨切割质量的评价维度与效率平衡策略,系统梳理硅晶圆激光切割的核心技术体系
2026-02-12
-
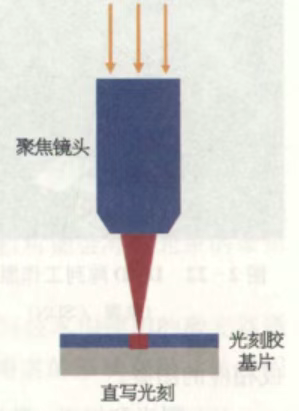
无掩模激光直写技术研究概述
无掩模激光直写技术作为微纳加工领域的先进光刻技术,摒弃了传统光刻工艺对掩模版的依赖,凭借直接写入的核心特性,在复杂微纳结构制备、高精度图案加工中展现出独特优势,成为微纳加工领域的重要技术方向。本文从工作原理与流程、技术特性、现存挑战、分辨率与对准参数、核心设备及厂务动力配套要求等方面,对该技术进行全面梳理与阐述。
2026-02-12
-

SiC功率器件的高温时代:封装成为行业发展核心瓶颈
在半导体功率器件技术迭代进程中,碳化硅(SiC)凭借高温工作、高电流密度、高频开关的核心优势,成为推动功率半导体升级的关键方向,其普及大幅提升了器件的功率密度与工作效率,为功率半导体行业发展带来全新机遇。但与此同时,行业发展的核心瓶颈正悄然从芯片设计与制造环节,转移至封装层面。当SiC将功率器件的工作温度与功率密度不断推高,芯片本身已具备承受更高应力的能力,而封装环节的材料适配、热路径设计等问题却日益凸显,高温与快速功率循环叠加的工况下,焊料与热路径成为决定SiC功率模块寿命的核心因素,封装技术的发展水平,正成为制约SiC功率器件产业化落地与长期可靠应用的关键。
2026-02-12







