光子学技术在心血管疾病诊疗领域的创新应用与发展展望
心血管疾病(CardiovascularDisease,CVD)作为全球首要致死病因,每年导致约2000万人死亡,其疾病谱涵盖冠状动脉疾病、心肌梗死、脑卒中、心律失常及心力衰竭等多种病症,对全球公共卫生体系构成严峻挑战。长期以来,计算机断层扫描(ComputedTomography,CT)、血管造影术等传统光子学技术虽为CVD的诊断与治疗提供了重要支撑,但受限于侵入性较强、功能信息获取有限、实时监测能力不足等固有短板,难以满足临床对精准化、无创化诊疗的需求。近年来,以光声成像、光学可穿戴传感、光动力疗法为代表的新兴光子学技术快速发展,通过融合光学原理与医学诊疗需求,在提升CVD诊断精度、优化治疗方案、拓展监测场景等方面展现出显著优势,正逐步推动心血管医学向更高效、更精准、更可及的方向变革。

一、诊断领域的技术革新:从结构成像到多维度精准评估
传统CVD诊断技术多聚焦于解剖结构呈现,难以同步获取功能、分子层面的关键信息,且部分技术存在侵入性操作风险。新兴光子学技术通过创新光学设计与检测原理,实现了从“静态结构观察”向“动态功能监测”、从“宏观成像”向“分子靶向识别”的跨越,为CVD早期筛查、精准诊断提供了全新解决方案。
(一)光声成像:无创获取血流动力学与组织代谢信息
光声成像技术整合了光学成像的高分辨率与超声成像的深组织穿透能力,其核心原理是利用特定波长激光照射生物组织,使组织内血红蛋白等光吸收物质产生热膨胀效应,进而激发超声信号,通过捕捉该信号实现组织成像。该技术可精准区分含氧血红蛋白与脱氧血红蛋白的分布差异,为心肌缺血的早期诊断提供关键依据——当冠状动脉供血不足时,心肌区域血氧饱和度会出现特征性下降,光声成像可实时捕捉这一变化,为冠状动脉疾病(CoronaryArteryDisease,CAD)的早期干预提供指导。
目前,手持式多光谱光声断层扫描系统已在临床研究中实现对颈动脉、外周血管的在体评估,不仅能清晰呈现血管壁结构,还可识别动脉粥样硬化斑块内的脂质核心、胶原纤维及斑块内出血等关键特征,为判断斑块稳定性(斑块破裂是急性心梗、脑卒中的主要诱因)提供量化指标,且全程无需侵入性操作,患者耐受性显著提升。
(二)光学可穿戴传感器:实现心血管生理指标的长期连续监测
针对高血压、心律失常等慢性CVD患者的长期管理需求,光学可穿戴传感器通过集成光电容积描记法(Photoplethysmography,PPG)、表面增强拉曼光谱(Surface-EnhancedRamanSpectroscopy,SERS)等技术,可无创、实时监测心率、血氧饱和度、血压等核心生理指标。其工作原理是利用特定波长光源照射皮肤组织,通过分析血液对光的吸收与反射变化,反演血管内血液体积波动及代谢状态——例如,基于PPG技术的智能手表已实现对心房颤动的初步筛查,通过识别心率节律异常,为心律失常的早期发现提供预警。
更前沿的植入式光学传感器结合经皮监测技术,可实现对心力衰竭患者心功能的长期跟踪,无需频繁穿刺或实验室检测即可获取连续数据,显著提升患者依从性,为慢性CVD的个性化管理提供数据支撑。
(三)纸质即时检测技术:推动CVD快速筛查向基层延伸
针对资源匮乏地区CVD筛查设备不足、检测成本高的问题,纸质即时检测技术通过整合纸质微流控芯片、纳米颗粒信号放大系统及便携式光学阅读器,构建了低成本、高灵敏度的CVD生物标志物检测平台。该技术仅需50μL血清样本,即可在15分钟内完成心肌肌钙蛋白I(TroponinI,急性心肌损伤的特异性标志物)的定量检测,检测限低至0.2pg/mL,满足临床对急性心梗早期诊断的需求。
通过引入深度学习算法优化多指标检测模块,该技术还可同步分析肌红蛋白、肌酸激酶同工酶(CK-MB)、C反应蛋白(CRP)等多个CVD相关生物标志物,操作流程简化、设备成本低廉,可有效填补基层医疗机构CVD快速筛查能力的空白,助力实现“早发现、早干预”的公共卫生目标。
二、治疗领域的技术突破:从广谱干预到靶向精准治疗
传统CVD治疗手段如药物溶栓、外科支架植入等,常面临治疗精准度不足、全身副作用明显、术后并发症风险较高等问题。新兴光子学技术以“光控靶向干预”为核心,通过精准调控光的波长、能量与作用时间,实现对病灶组织的特异性作用,减少对健康组织的损伤,为CVD治疗提供了更安全、更高效的方案。
(一)光动力疗法:靶向调控动脉粥样硬化斑块进展
光动力疗法(PhotodynamicTherapy,PDT)最初应用于肿瘤治疗,近年来在动脉粥样硬化治疗中展现出独特优势。其治疗原理为:首先向患者体内注射光敏剂,待光敏剂选择性富集于动脉粥样硬化斑块后,采用特定波长激光照射病灶区域,激活光敏剂产生活性氧(ReactiveOxygenSpecies,ROS)。ROS可选择性破坏斑块内的异常细胞(如泡沫细胞)及extracellularmatrix成分,实现斑块体积缩小,同时不损伤周围正常血管内皮组织。
临床前研究表明,以5-氨基乙酰丙酸衍生的原卟啉IV为光敏剂的PDT,可显著抑制动脉粥样硬化斑块内的炎症反应与氧化应激,降低斑块破裂风险——而斑块破裂正是急性心梗、脑卒中的主要致病机制。该技术为CAD的治疗提供了“分子层面”的干预手段,有望成为药物与手术治疗之外的重要补充。
(二)激光溶栓术:无创高效清除血栓病灶
血栓性疾病(如急性缺血性脑卒中、深静脉血栓)的传统治疗以药物溶栓为主,但存在出血风险高、部分患者药物禁忌等局限。激光溶栓术通过采用准分子激光、Nd:YAG激光等脉冲激光系统,利用激光能量在血栓内部产生空化泡与冲击波,将血栓分解为直径小于10μm的微小碎片(可被机体安全吸收),实现无创血栓清除。
与药物溶栓相比,激光溶栓术具有以下优势:一是精准性高,可通过光学相干断层扫描(OpticalCoherenceTomography,OCT)等实时成像技术定位血栓,调整激光能量参数,减少对血管壁的损伤;二是安全性好,无需依赖抗凝血药物,显著降低出血并发症风险,尤其适用于老年、肝肾功能不全等高危患者。目前,该技术已在动物实验中证实对动脉闭塞、深静脉血栓的治疗效果,临床转化潜力显著。
(三)光遗传学调控:精准干预心脏电生理活动
心律失常的传统治疗以电除颤、心脏起搏器植入为主,但电刺激易影响大片心肌组织,导致心肌损伤、电极脱位等副作用。光遗传学调控技术通过基因工程手段,使心肌细胞表达光敏离子通道(如Channelrhodopsin-2),再利用特定波长光源(如蓝光)照射心脏特定区域,精准调控心肌细胞的电活动,实现心率与节律的靶向调节——相当于构建了“光控心脏起搏器”。
动物实验已证实,无创光遗传学系统可在自由活动的小鼠体内实现细胞类型特异性的心率调控,例如通过靶向刺激窦房结区域心肌细胞,纠正窦性心动过缓;通过抑制心肌梗死周边异常兴奋灶,改善室性早搏。该技术为心律失常的精准治疗提供了全新思路,尤其适用于对传统电起搏器不耐受的患者。
三、人工智能与光子学的融合:推动CVD诊疗向智能化升级
新兴光子学技术在CVD诊疗中可产生海量高维度数据(如光声成像的血管结构数据、光流体成像的血小板动态数据),传统人工分析方法存在效率低、主观性强、易遗漏关键信息等问题。人工智能(ArtificialIntelligence,AI)技术的引入,通过机器学习、深度学习等算法实现数据的自动化处理与分析,显著提升了光子学技术的诊疗效能,推动CVD诊疗从“经验驱动”向“数据驱动”转型。
在诊断环节,深度学习算法可优化光子学成像质量与信息提取效率。例如,基于卷积神经网络(ConvolutionalNeuralNetwork,CNN)的图像增强模型,可显著提升OCT血管造影图像的清晰度,更精准识别动脉粥样硬化斑块的纤维帽厚度、巨噬细胞浸润程度;基于循环神经网络(RecurrentNeuralNetwork,RNN)的动态分析模型,可通过光流体成像数据实时监测血小板聚集过程,区分新冠肺炎相关血栓与普通血栓,为血栓病因诊断提供量化依据。
在治疗环节,AI技术可助力个性化治疗方案制定。例如,在激光消融治疗中,机器学习模型可通过分析患者的血管直径、斑块硬度、血流速度等多维度数据,实时调整激光能量、作用时间等参数,避免过度消融导致的血管损伤;“数字孪生”技术通过整合血管造影、CT数据,构建患者专属的心血管数字模型,可模拟支架植入、光遗传学调控等治疗过程,提前优化手术方案,降低术中风险。
四、技术转化挑战与未来发展方向
尽管新兴光子学技术在CVD诊疗中展现出显著潜力,但从实验室研究向临床应用转化仍面临多重挑战,需通过多学科协作、政策支持与技术创新协同突破。
(一)核心挑战:可及性、监管与小型化
1.可及性与可负担性不足:光声成像、光流体成像等技术依赖精密光学组件与专业操作设备,成本较高,难以在基层医疗机构及资源匮乏地区普及。同时,技术操作需专业人员培训,进一步限制了其推广应用。
2.监管审批流程复杂:光子学诊疗设备需通过美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)、中国国家药品监督管理局(NMPA)等机构的严格安全性与有效性评估,审批周期长(通常3-5年),可能延缓技术临床转化进程。
3.小型化与便携化不足:现有多数光子学设备体积较大、依赖外接电源,难以满足床旁检测、居家监测等场景需求,限制了其在慢性CVD长期管理中的应用。
(二)未来发展策略
1.降低技术成本,提升可及性:通过采用低成本材料(如塑料光学组件、纸质微流控芯片)、简化制造工艺(如3D打印技术)、推动规模生产,降低设备成本;同时开发智能化操作界面,减少对专业人员的依赖,推动技术向基层延伸。
2.优化监管机制,加速临床转化:建议监管机构建立“突破性医疗器械”加速审批通道,对具有显著临床价值的光子学技术实施“有条件批准+上市后监测”模式;鼓励产学研协作,在技术研发早期引入监管专家参与,提前规避合规风险。
3.推动技术小型化,拓展应用场景:依托纳米技术、柔性电子学等领域的进展,开发微型化光学传感器(如可植入式光纤传感器)、便携式成像设备(如手持式光声成像仪),实现CVD的床旁诊断与居家监测,提升患者诊疗体验。
4.深化跨学科融合:加强光子学、材料科学、计算机科学与心血管医学的交叉合作,例如通过开发新型生物相容性光敏剂提升PDT治疗效果,通过AI算法优化光子学数据的临床解读,推动技术向更精准、更安全的方向发展。
五、结语
新兴光子学技术通过创新诊断模式、优化治疗方案、拓展监测场景,为CVD诊疗提供了全新解决方案,尤其在无创化、精准化、智能化方面的突破,有望显著降低CVD的全球疾病负担。尽管技术转化仍面临可及性、监管、小型化等挑战,但随着产学研用协同创新的深入推进,以及AI、纳米技术等跨领域技术的融合应用,光子学技术必将在心血管医学领域发挥更重要作用,推动CVD诊疗进入“精准化、个性化、可及化”的新时代,为全球心血管健康治理提供有力支撑。
-

半导体抛光设备自动化应用及工艺质量管控要点探析
在半导体器件规模化量产进程中,抛光工艺作为保障晶圆加工精度与表面质量的核心环节,其设备自动化水平、工艺参数调控能力、检测体系完善度及异常处置效率,直接决定生产效率、工艺稳定性与产品良率。本文从抛光设备自动化配置要求、核心工艺参数调控、关键检测指标界定及常见工艺异常处理四个维度,系统阐述半导体抛光工艺的质量管控核心要点,为半导体抛光制程的标准化、精细化实施提供参考。
2026-02-12
-
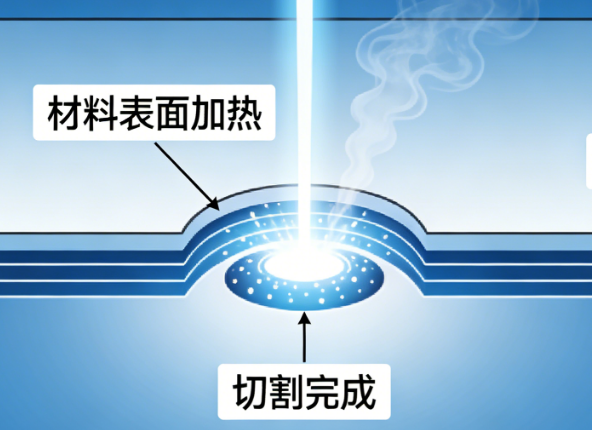
硅晶圆激光切割核心技术深度解析:原理、工艺与质量把控
在半导体制造产业链中,硅晶圆切割是芯片成型的关键工序,其加工精度与效率直接影响芯片良品率和产业发展节奏。随着微电子器件向微型化、薄型化升级,传统切割方式的弊端逐渐显现,激光切割凭借高精度、低损伤的技术优势成为行业主流。本文从激光切割系统的硬件构成出发,深入拆解隐形切割与消融切割两大核心工艺,解析光斑、焦点的精度控制逻辑,并探讨切割质量的评价维度与效率平衡策略,系统梳理硅晶圆激光切割的核心技术体系
2026-02-12
-
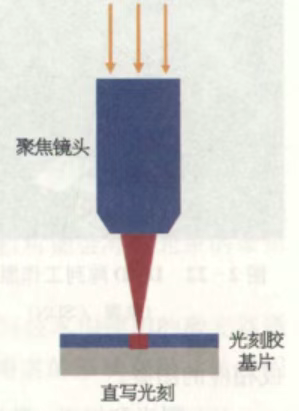
无掩模激光直写技术研究概述
无掩模激光直写技术作为微纳加工领域的先进光刻技术,摒弃了传统光刻工艺对掩模版的依赖,凭借直接写入的核心特性,在复杂微纳结构制备、高精度图案加工中展现出独特优势,成为微纳加工领域的重要技术方向。本文从工作原理与流程、技术特性、现存挑战、分辨率与对准参数、核心设备及厂务动力配套要求等方面,对该技术进行全面梳理与阐述。
2026-02-12
-

SiC功率器件的高温时代:封装成为行业发展核心瓶颈
在半导体功率器件技术迭代进程中,碳化硅(SiC)凭借高温工作、高电流密度、高频开关的核心优势,成为推动功率半导体升级的关键方向,其普及大幅提升了器件的功率密度与工作效率,为功率半导体行业发展带来全新机遇。但与此同时,行业发展的核心瓶颈正悄然从芯片设计与制造环节,转移至封装层面。当SiC将功率器件的工作温度与功率密度不断推高,芯片本身已具备承受更高应力的能力,而封装环节的材料适配、热路径设计等问题却日益凸显,高温与快速功率循环叠加的工况下,焊料与热路径成为决定SiC功率模块寿命的核心因素,封装技术的发展水平,正成为制约SiC功率器件产业化落地与长期可靠应用的关键。
2026-02-12







