暗场光学切片技术能否破解荧光显微成像的背景干扰困局?
在生物医学领域,荧光显微成像如同科学家窥探生命奥秘的“眼睛”,其分辨率与清晰度直接决定了我们对微观世界的认知深度。然而,当光线穿透生物组织时,散射效应形成的离焦背景如同笼罩在图像上的“迷雾”,不仅模糊了精细结构,更成为限制深层组织成像的关键难题。近期,北京大学席鹏教授与深圳大学屈军乐教授团队在《Nature Methods》发表的“Dark-based optical sectioning assists background removal in fluorescence microscopy”研究,以计算机视觉与光学成像的跨界融合,为这一困境提供了革命性解决方案。
传统光学层切技术的困境与突破契机
传统荧光显微成像为对抗背景干扰,发展出共聚焦、多光子、光片荧光等光学层切技术。这些方法通过调控光路抑制离焦信号,却面临硬件系统复杂昂贵、高速成像时标受限、强光激发导致光毒性等挑战。即便采用组织透明化等生物学手段,也因样本制备繁琐、可能破坏组织结构而难以普及。更根本的矛盾在于:高散射深部组织中,现有技术无论怎样优化光路,都无法完全规避散射引发的背景干扰,导致图像对比度下降、定量分析失真。
研究团队从自然图像去雾技术中获得灵感——大气散射与荧光散射在图像频域表现出惊人的结构相似性,均呈现低频加性模糊特征。受此启发,他们提出“暗通道光学层切算法(Dark Sectioning)”,通过计算图像处理而非硬件改造,实现离焦背景的智能识别与抑制。这种“以软补硬”的思路,彻底打破了传统技术对高端光学元件的依赖。
暗通道算法的技术内核与创新设计
Dark Sectioning的核心在于将自然图像“暗通道去雾”理论与荧光成像物理特性深度融合。其算法流程蕴含三大创新突破:
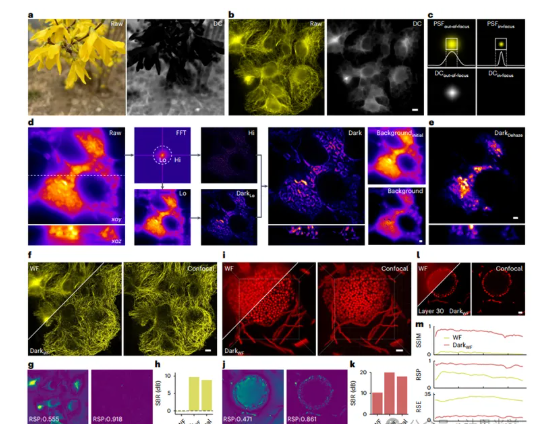
高低频智能分离策略:将原始图像分解为高频细节信号与低频背景成分,仅对低频部分进行背景估计,避免传统方法中弱荧光信号被误删的问题。例如在U2OS细胞微管成像中,该策略使纳米级结构细节保留率提升40%以上。
物理驱动的PSF建模:结合样本深度、成像参数等因素生成自适应点扩展函数,指导图像块划分与滤波窗口调整。在三维曲霉孢头成像实验中,此机制使轴向分辨率提升至共聚焦系统的86%,而数据采集速度提高3倍。
迭代背景抑制机制:通过多级低通滤波模拟离焦背景分布,支持单次快速处理与复杂场景下的多次迭代。在小鼠肾脏组织切片实验中,经3次迭代处理后,肌动蛋白丝图像的信背比(SBR)从4.3提升至9.1,超越传统HiLo成像技术。
与自然图像去雾不同,荧光图像的暗通道处理面临独特挑战:离焦背景的局部非均匀性(如不同深度组织的散射差异)、荧光信号的稀疏动态范围(生物分子表达的非线性特征)。为此,算法引入局部统计建模与非线性抑制函数,在小鼠脑部神经元成像中,成功将距表面650μm深处的神经元信噪比提升2.3倍,使原本淹没在背景中的细胞体清晰可辨。
跨模态验证与多场景应用突破
研究团队通过系统的交叉实验,验证了Dark Sectioning在多种成像模式下的普适性:
宽场成像升级:仅用普通宽场图像,即可重建出接近共聚焦质量的结果。在COS-7细胞内质网成像中,处理后的图像结构保真度(RSP)达0.918,较原始宽场提升65%,误差率(RSE)降低82%。
超分辨成像增强:与结构光照明显微(SIM)结合时,有效抑制照明条纹伪影。在三维SIM重建中,线粒体成像的信背比提升37%,肌动蛋白丝的方向解析精度提高1.7°。
活体动态成像突破:在小鼠皮下血管实时观测中,克服组织散射导致的模糊,使直径10μm以下的微血管边缘锐利度提升50%,在15Hz高速采集下仍保持信号稳定性。
该技术在生物医学多个领域展现出变革性应用潜力:
深层神经科学:助力650μm深度神经元成像,结合深度学习分割模型,使神经元识别率提升38%,为阿尔茨海默病等神经退行性疾病研究提供高精度成像工具。
病理诊断革新:在200μm厚前列腺肿瘤组织成像中,将三维荧光图像转化为仿HE染色图像,细胞核边界清晰度提升60%,计数准确率达92%,为数字病理高通量评估奠定基础。
全脑光学成像:在透明化小鼠全脑组织中,抑制残留散射背景,神经纤维网络对比度提升45%,支持厘米级脑区的精细结构解析。
计算成像新范式的未来图景
Dark Sectioning的诞生标志着荧光显微成像从“硬件主导”向“计算赋能”的范式转变。这种无需改造光学系统、仅通过算法升级即可提升成像质量的方案,为资源有限的实验室提供了高性价比解决方案。更重要的是,其与现有技术的兼容性展现出广阔拓展空间——可集成于光片、光场、受激发射损耗等高端成像系统,也能与深度学习超分辨率算法协同,形成“光学采集+计算增强”的闭环方案。
从技术演进角度看,该研究开辟了计算光学成像的新路径:通过挖掘图像内在统计特征与物理成像模型的结合点,实现对光学原理的计算重构。未来,随着算法在不同组织类型、成像模态中的进一步优化,Dark Sectioning有望成为连接传统显微技术与新兴智能成像的桥梁,推动生物医学成像在精度、深度与通量上的全面突破,为揭示生命复杂系统的动态奥秘提供更强大的技术支撑。
-

半导体抛光设备自动化应用及工艺质量管控要点探析
在半导体器件规模化量产进程中,抛光工艺作为保障晶圆加工精度与表面质量的核心环节,其设备自动化水平、工艺参数调控能力、检测体系完善度及异常处置效率,直接决定生产效率、工艺稳定性与产品良率。本文从抛光设备自动化配置要求、核心工艺参数调控、关键检测指标界定及常见工艺异常处理四个维度,系统阐述半导体抛光工艺的质量管控核心要点,为半导体抛光制程的标准化、精细化实施提供参考。
2026-02-12
-
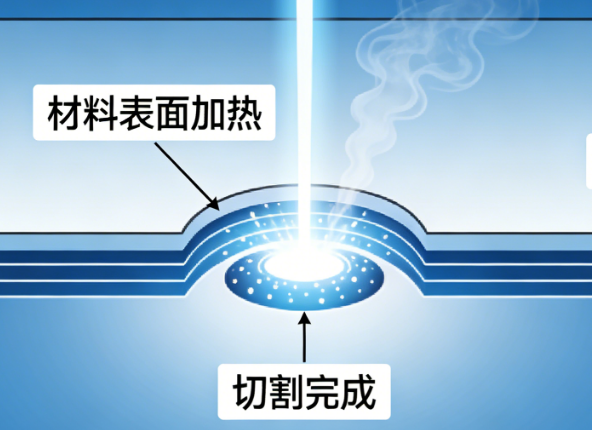
硅晶圆激光切割核心技术深度解析:原理、工艺与质量把控
在半导体制造产业链中,硅晶圆切割是芯片成型的关键工序,其加工精度与效率直接影响芯片良品率和产业发展节奏。随着微电子器件向微型化、薄型化升级,传统切割方式的弊端逐渐显现,激光切割凭借高精度、低损伤的技术优势成为行业主流。本文从激光切割系统的硬件构成出发,深入拆解隐形切割与消融切割两大核心工艺,解析光斑、焦点的精度控制逻辑,并探讨切割质量的评价维度与效率平衡策略,系统梳理硅晶圆激光切割的核心技术体系
2026-02-12
-
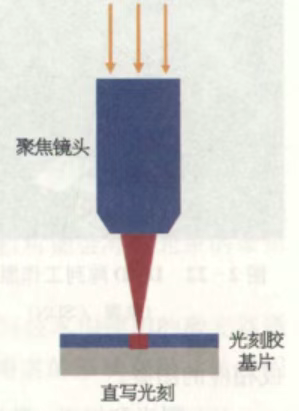
无掩模激光直写技术研究概述
无掩模激光直写技术作为微纳加工领域的先进光刻技术,摒弃了传统光刻工艺对掩模版的依赖,凭借直接写入的核心特性,在复杂微纳结构制备、高精度图案加工中展现出独特优势,成为微纳加工领域的重要技术方向。本文从工作原理与流程、技术特性、现存挑战、分辨率与对准参数、核心设备及厂务动力配套要求等方面,对该技术进行全面梳理与阐述。
2026-02-12
-

SiC功率器件的高温时代:封装成为行业发展核心瓶颈
在半导体功率器件技术迭代进程中,碳化硅(SiC)凭借高温工作、高电流密度、高频开关的核心优势,成为推动功率半导体升级的关键方向,其普及大幅提升了器件的功率密度与工作效率,为功率半导体行业发展带来全新机遇。但与此同时,行业发展的核心瓶颈正悄然从芯片设计与制造环节,转移至封装层面。当SiC将功率器件的工作温度与功率密度不断推高,芯片本身已具备承受更高应力的能力,而封装环节的材料适配、热路径设计等问题却日益凸显,高温与快速功率循环叠加的工况下,焊料与热路径成为决定SiC功率模块寿命的核心因素,封装技术的发展水平,正成为制约SiC功率器件产业化落地与长期可靠应用的关键。
2026-02-12







